真實測試,AlphaFold3真有那么神奇?
2024年5月8日,Google旗下DeepMind團隊和AI制藥公司Isomorphic Labs在《自然》網站上發布了一顆重磅炸彈——AlphaFold3。與上一代AlphaFold2相比,AlphaFold3能夠以前所未有的精確度預測所有生命分子(蛋白質、DNA、RNA、小分子化合物、金屬離子等)的復合物結構和相互作用,比現有所有方法的預測精度至少提升了50%,再次“一覽眾山小”。
蛋白質與核酸的相互作用,此前是一直是生物大分子結構預測的難題,也是分子生物學工具酶開發的迫切需求。愚公生物也用真實數據測試了AlphaFold3在分子酶方面的表現,看看究竟有多神奇。
首先選擇最常用的限制酶之一BamHI。BamHI屬于Type IIP類限制酶,一般以二聚體形式行使功能。我們預測了BamHI二聚體、DNA底物和Mg2+的復合物結構,并與1994年解析的晶體結構對比。預測結構與晶體結構在催化核心周圍的一致性還是相當好的,DNA識別序列(白色+紅色)和切割位點(紅色)的定位也很準確,晶體結構中缺少的Mg2+也準確定位到了切割位點附近。但是預測結果的C端(黃色虛線框)可信度不高,與晶體結構有顯著差異。
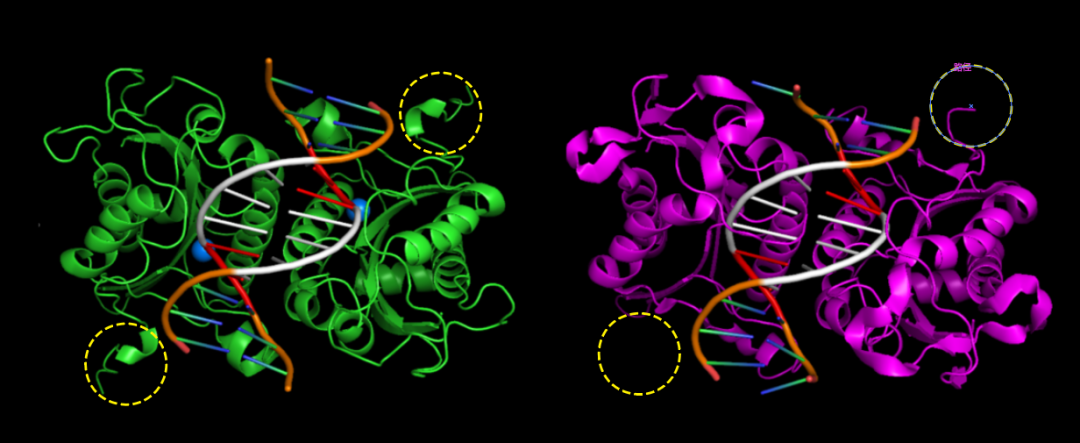
左為BamHI預測結構,右為晶體結構
隨后選擇了一個尚未解析晶體結構的限制酶。以往的研究推測該酶可能也是以二聚體形式發揮作用。當我們用AlphaFold3分別預測該酶野生型和突變體的二聚體和DNA復合物結構時,有意思的事情發生了:僅僅改變一個氨基酸,預測的復合物結構出現了完全不同的構象,不僅僅是二聚體的排列發生了變化,單體蛋白的結構也完全不同。但無論哪個預測的復合物結構,都不太容易解釋已知的生化實驗結果,表明這兩個預測結構與真實結構之間還存在顯著差異。
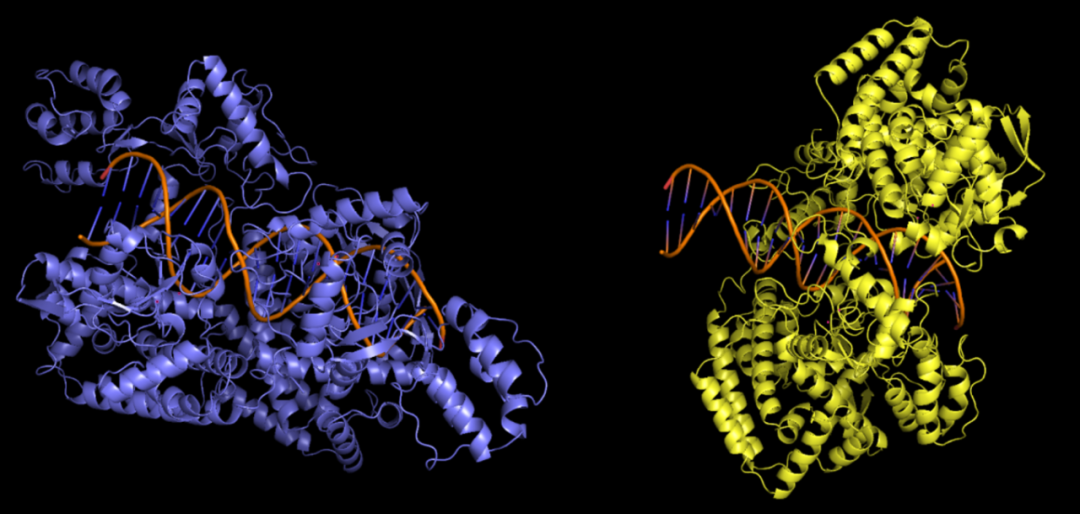
左為野生型預測結構,右為突變體預測結構
再換一個自行解析了單體晶體結構的核酸酶,生化實驗證明該酶也是以二聚體行使功能。AlphaFold3預測的復合物結構中,單體結構與晶體結構幾乎完美契合;但改變核酸底物后,卻發現二聚體出現了完全相反的排列形式。
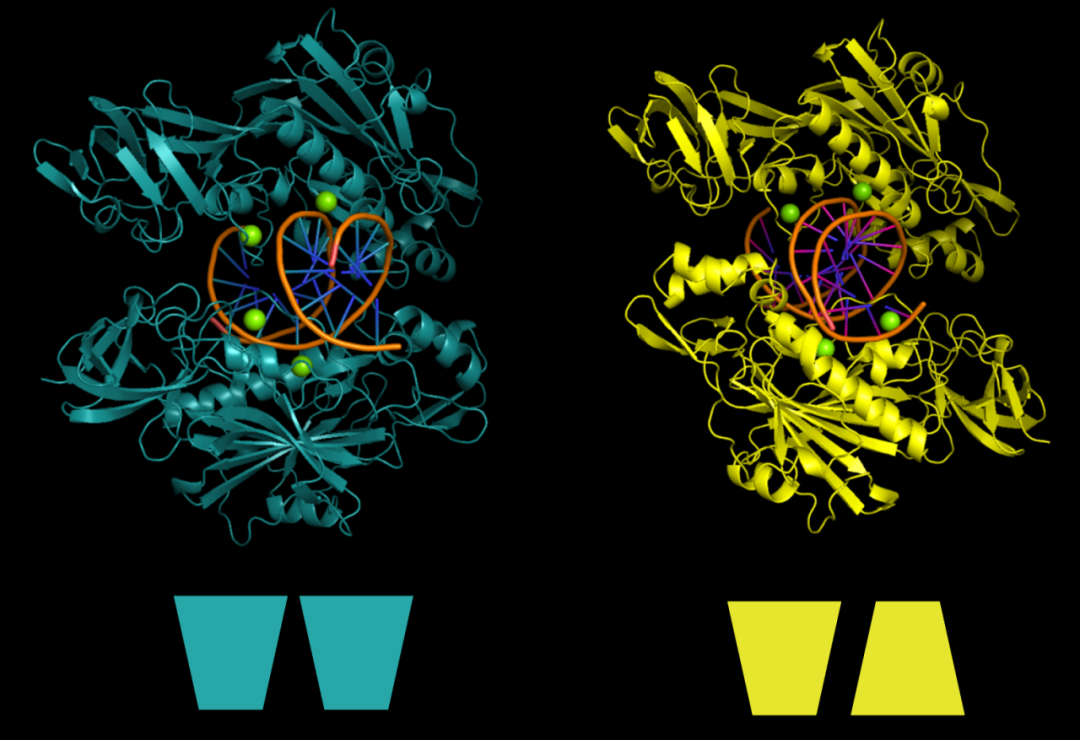
左為底物1預測結構,右為底物2預測結構
上述三個例子表明,AlphaFold3雖然在蛋白質-DNA復合物結構預測方面取得了長足的進步(后兩個例子此前使用RosseTTAFold2NA幾乎無法預測出來),但還遠遠沒有達到某些自媒體所說“AlphaFold3已經解決這個問題”的程度。對于研究核酸酶結構功能并開發新產品而言,必要的結構生物學和生物化學實驗仍然不可或缺。
當然,目前對公眾開放的AlphaFold Server只是一個無法調整參數的簡化版,并沒有釋放開源的完整版。畢竟AlphaFold3的研發團隊里第一次出現了商業化公司Isomorphic Labs,投資總是要追求回報的。關于AlphaFold3開始“下海”這件事情,科學界也有很大的爭議,后續如何發展,也讓我們拭目以待。
相關產品



